- HOME
- 本プログラムについて
- ターゲットタンパク研究「基本的な生命の解明」分野
- V-ATPaseからの創薬
創薬に繋がるV-ATPaseの構造、機能の解明(H19〜H21)
創薬に繋がる輸送体膜蛋白質の構造、機能の解明(H22改題)
代表機関:京都大学大学院医学研究科
代表研究者:岩田 想
2010年版パンフレット(背景と成果)の該当ページはこちら
細胞の中では、エネルギー生産や物質の輸送などさまざまな活動が行われていますが、その効率は細胞内の環境によって大きく左右されます。細胞内の環境の良し悪しを決める大きな要素の一つはpH(酸性やアルカリ性を示す指標となるもの)です。通常、細胞内のpHは厳密に調整されており、細胞の活動が効率よく進むための環境が整っています。
pHの調整役として働いているのはV-ATPaseという酵素です。この酵素は、ヒトなどの真核生物の生体膜に存在し、水素イオンを膜の外から中に運ぶことで膜内のpHを調整しています(水素イオン濃度が高いほど酸性になります)。また、V-ATPaseは骨の形成に関わる破骨細胞やがん細胞の膜にも存在しており、骨粗鬆症やがん細胞の増殖・転移に関与していることがわかっています。そのため、V-ATPaseのはたらきを阻害する物質は、こうした疾患の治療薬として期待されているのです。
私たちは、細菌のように核をもたない原核生物にもV-ATPaseと似た酵素があることを発見しました。すでにこの酵素の構造や機能について多くの成果を出しており、当課題では、原核生物のV-ATPaseをモデルとして利用し、ヒトのV-ATPaseを阻害する物質を見つけようと考えています。
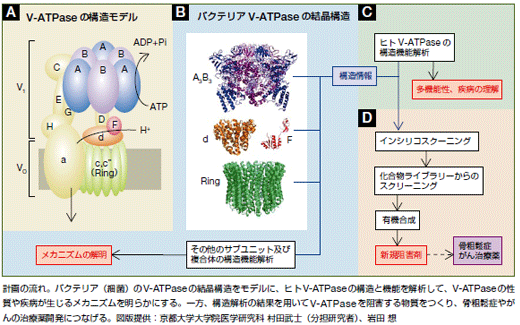
V-ATPaseのはたらくしくみについて、次のようなことがわかっています。V-ATPaseは図Aのように膜の外にあるV1と膜の内部にあるVoからなり、Voには車輪のように回転する「ローターリング」という構造があります。Voの部分でATPからエネルギーを取り出し、そのエネルギーでV1のローターリング部分が回転すると、水素イオンが膜の外から中に移動します。水素イオンが入ってくることで膜の内部は酸性に傾くのです。
V-ATPaseの阻害剤を見つけるためには、このしくみを分子レベルで理解しなければいけません。そこで、私たちはV-ATPase複合体の構造解析に取り組んでいます。V-ATPaseはいくつもの部品(サブユニット)からなる「超複合体」という複雑な構造をとっているため、一気に全体の立体構造を明らかにすることが難しいので、部分的な構造解析を積み重ね、全体構造を理解していく方向でも研究を進めています。
現在では、次のステップにも取りかかっており、コンピューターを用いて阻害剤となる候補化合物をいくつか選別し、実験によってさらに絞り込んでいます。最終的には、得られた化合物の構造をもとにしてV-ATPaseの新しい阻害剤を創出したいと考えています。

 サイト内検索
サイト内検索