- HOME
- 本プログラムについて
- ターゲットタンパク研究「基本的な生命の解明」分野
- クロマチン構造と転写
クロマチン上での基本転写因子、転写制御因子、ヒストン修飾因子の構造生物学
代表機関:横浜市立大学大学院生命ナノシステム科学研究科
代表研究者:西村善文
2010年版パンフレット(背景と成果)の該当ページはこちら
ヒトの細胞では、全長約2mのDNAがびっしり折りたたまれて、直径わずか数μmの核に収納されています。このような状態から、いったいどのようにして特定の場所のDNAが読み取られるのかとても不思議です。
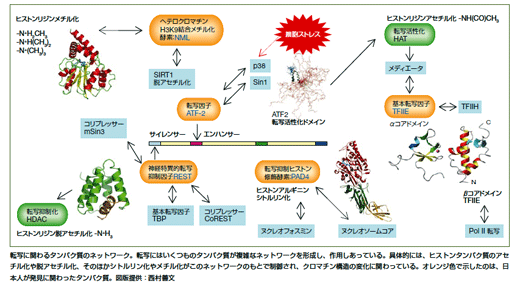
折りたたまれたDNAを詳しく見ると、DNAの鎖がヒストンというタンパク質に巻きついた数珠状の構造を取っています。これをクロマチンといいます。ヒストンはもともと正の電気を帯びており、負の電気を帯びたDNAとしっかり結合しているのですが、遺伝子の発現が起こるときには、ヒストンの一部でアミノ酸が変化し(この場合は「アセチル化」という反応が起きます)、そこの部分は正の電気を失います。すると、DNAの鎖がヒストンから離れて、そこにさまざまなタンパク質が作用することで転写が始まるのです。また、「脱アセチル化」という逆の反応が起こるとクロマチンの構造は固くなり、転写は抑えられます。
こうしたクロマチン上での現象には、たくさんのタンパク質がネットワークを形成し、複雑に関わりあっています。ここ20年の間に、日本の研究者たちが転写に関わるタンパク質をいくつも発見し、その機能を明らかにしてきました。私たちはこれらのタンパク質を軸にして、ネットワークの各接点におけるタンパク質複合体の構造を解析し、転写が起こるしくみを探っています。
これまで、転写の開始に関わるTFIIEというタンパク質の核となる部分や、転写の調節に関わるATF-2やRESTというタンパク質の作用を起こす部分の構造を明らかにしました。構造解析の結果から、これらのタンパク質は構造の一部が不安定で形が定まっておらず、ほかのタンパク質と結合することで決まった形をとるという変わった性質をもつことがわかりました。今後の研究で、こうした構造面の性質と機能の関係を明らかにしようと考えています。
また、クロマチン構造の変化に関わるPAD4というタンパク質とヒストンとの複合体構造の解析も終了しています。さらに、クロマチンの構造を強固にさせて転写を抑えるNMLというタンパク質も最近見つかっており、このタンパク質の構造を分担研究者である横浜市立大学大学院国際総合科学研究科の佐藤衛教授と清水敏之准教授らのチームが調べています。

 サイト内検索
サイト内検索